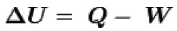Podemos dizer que a ideia do átomo partiu do seguinte princípio: se quebrarmos um objeto qualquer em pequenos pedacinhos menores, chegaria um momento em que não conseguiríamos mais quebrá-lo. Dessa forma, inicialmente propôs-se que o átomo seria indivisível. Porém, hoje sabemos que não se trata de uma partícula indivisível, mas sim de um sistema composto por diferentes partículas. A física nuclear estuda as propriedades e o comportamento dos núcleos atômicos e os mecanismos das reações nucleares. Esta área da ciência teve início a partir da evolução do conceito científico a cerca da estrutura atômica, pois até meados do século XIX acreditava-se que os átomos eram esferas maciças indestrutíveis e indivisíveis. Esses conceitos estavam de acordo com a teoria atômica de John Dalton.
Basicamente, a física nuclear faz de objetos de estudo as propriedades e o comportamento dos núcleos atômicos, bem como os mecanismos básicos das reações nucleares com nêutrons e outros núcleos. Assim, podemos classificar essas propriedades como sendo estáticas (cargas, massa, energia de ligação, etc.) e dinâmicas (radioatividade, estados excitados, etc.).
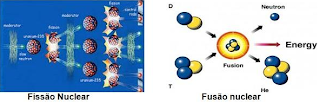
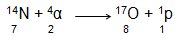
A quebra de um núcleo atômico resulta em novos núcleos e produz uma grande liberação de energia porque a massa total dos novos elementos é menor que a do núcleo original. A massa que sobra é emitida sob a forma de energia. Isto é chamado de Fissão Nuclear. Essa é a base do funcionamento de Usinas Nucleares, com a fissão controlada para produzir eletricidade, e também é o princípio das primeiras bombas atômicas.
A Física nuclear é analisada através de modelos nucleares que são baseados na mecânica quântica, relatividade e teoria quântica de campos. A descoberta de que os núcleos (prótons e nêutrons) são na realidade sistemas compostos, redirecionou o interesse dos físicos nucleares para a investigação dos graus de liberdade de quarks e, com isto, atualmente os domínios da pesquisa da física nuclear e da física de partículas se tornaram interligados.
Para extrair um elétron de um átomo, é necessária certa quantidade de energia. Da mesma forma, cada núcleo (próton ou nêutron) necessita também de grande quantidade de energia, que é da ordem de milhões de vezes. Por esse motivo, a física nuclear é denominada física de alta energia.
Partindo desse princípio, é possível fazer uma classificação básica das forças que existem, sendo elas:
- Força gravitacional, que faz uma relação direta de atração mútua entre corpos, sendo responsável pela órbita dos planetas.
- Forças eletromagnéticas, que dão origem aos fenômenos elétricos, às reações químicas e aos ímãs.
- Força nuclear fraca, que produz o decaimento, no qual um elétron é emitido do núcleo.
- Força nuclear forte, que é responsável por manter as partículas do núcleo unidas, mesmo contendo cargas elétricas iguais.
Entre as aplicações mais conhecidas da Física Nuclear está a geração de energia elétrica em usinas nucleares. Reações nucleares de fissão controladas produzem calor aquecendo água que movimenta turbina para produzir eletricidade. Na medicina os Raios X permitem enxergar ossos e outras partes do interior do corpo humano; tratamentos de câncer utilizam efeitos nucleares como arma para combater os tumores (radiologia); elementos radioativos (que emitem partículas ou radiações) são usados para estudos do cérebro e outras partes do corpo. A Física Nuclear também pode ser usada para produzir os armamentos mais destrutivos da história, as bombas nucleares.
Principais teorias
Einstein incorporou a existência do átomo em suas teorias. Até então o átomo era visto como uma suposição teórica sem prova material. O físico alemão também formulou a teoria pela qual matéria e energia são equivalentes. Segundo ele:
E = M . C²
E = energia | m = massa | c = velocidade da luz
Através da fórmula podemos calcular quanta energia existe em um objeto de massa m. Como massa e energia são equivalentes, o Princípio da Conservação da Massa se resume ao Princípio da Conservação da Energia segundo o qual em um sistema fechado a Energia não pode ser criada nem destruída, ela apenas se transforma.
Quando átomos de hidrogênio se juntam para formar um átomo de hélio, existe grande perda de massa que é transformada em energia. Esta é a Fusão Nuclear, processo que gera a luz e calor do Sol e que é usado na mais poderosa arma já criada pelo homem: a bomba de Hidrogênio. Ele só ocorre em locais de altíssima temperatura e pressão. Atualmente pesquisadores estudam formas de utilizar a Fusão para produzir eletricidade.
Ao estudar as partículas que compõe a matéria, a Física Nuclear se aproxima de outra área: a Física de Partículas. Esta investiga quais são e como se comportam as partículas que compõe o Universo mostrando de forma muito clara que o átomo, o seu núcleo ou mesmo prótons ou nêutrons não são indivisíveis.
em Informática no Instituto Federal do Maranhão
Equipe É Hora de FisicoQuímica
Equipe É Hora de FisicoQuímica